Введение в коррозию
Коррозия происходит от латинского слова "coirosio" - разрушение, разъедание. Термин характеризует как процесс разрушения материалов, так и результат этого разрушения.
Коррозия начинается с поверхности металла и при дальнейшем развитии процесса распространяется вглубь. Металл при этом может частично или полностью растворяться, или могут образовываться продукты коррозии в виде осадка на металле.
Основной причиной, вызывающей коррозионное разрушение металлов и сплавов, является протекание на их поверхности электрохимических или химических реакций вследствие действия внешней среды.
В зависимости от характера этих реакций коррозионные процессы проходят по двум механизмам - химическому и электрохимическому.
1. К химической коррозии относятся процессы, которые протекают при непосредственном химическом взаимодействии металла и агрессивной среды и не сопровождающиеся возникновением электрического тока. Этот вид коррозии является гетерогенной химической реакцией жидкой или газообразной среды с поверхностью металла.
По химическому механизму на металлическую поверхность действуют:
а) сухие газы и пары при невозможности конденсации влаги на поверхности металла (газовая коррозия);
б) жидкие неэлектролиты, т.е. не проводящие электрический ток жидкости (спирты, минеральные масла и различные органические соединения).
Газовая коррозия обычно наблюдается при высоких температурах (окисление металлов кислородом при высокой температуре). В большинстве случаев при газовой коррозии на поверхности металлов образуется слой окислов. Механизм газовой коррозии сводится к двусторонней диффузии действующей среды и атомов металла через этот слой окислов.
2. К электрохимической коррозии, являющейся гетерогенной электрохимической реакцией, относятся коррозионные процессы, протекающие в водных растворах электролитов, влажных газах, расплавленных солях и щелочах. При электрохимической коррозии процесс растворения металла сопровождается появлением электрического тока, то есть упорядоченным передвижением электронов и ионов от одного участка металла к другому. При этом электрический ток возникает вследствие протекания процесса коррозии, а не за счет его подвода от внешнего источника.
Одно из принципиальных различий между этими двумя механизмами коррозии металлов заключается в том, что при электрохимической коррозии одновременно происходят два процесса окислительный (растворение металла на одном участке) и восстановительный (выделение катиона из раствора, восстановление кислорода и других окислителей на другом участке металла). Например, в результате растворения цинка в серной кислоте образуются ионы цинка и выделяется газообразный водород; при действии воды железо переходит в окисное или гидроокисное состояние и восстанавливается кислород с образованием гидроксильных ионов.
Электрохимическая коррозия, в зависимости от характера агрессивной среды и условий протекания, может быть: кислотная (в растворах кислот); щелочная (в растворах щелочей); солевая (в водных растворах солей); в расплавленных солях и щелочах; атмосферная (в атмосфере воздуха или любого другого газа); почвенная (под воздействием на металл почвы или фунта), коррозия внешним током или электрокоррозия (под влиянием тока от внешнего источника); контактная (вызываемая контактом двух разнородных металлов, имеющих различные потенциалы).
При этих условиях возможные также следующие виды коррозии:
1) под напряжением - одновременное действие на металл коррозионной среды и механических напряжений. Коррозия при постоянных растягивающих внешних напряжениях или нагрузках называется коррозионным растрескиванием, при переменных нагрузках - коррозионной усталостью;
2) коррозионная кавитация - коррозия металла в условиях ударного действия агрессивной среды (разрушение лопастей гребного винта парохода);
3) коррозия при трении;
4) биокоррозия (с участием продуктов выделения микроорганизмов в грунтах и электролитах.
Процессы на границе "металл - раствор электролита". Явления, которые происходят на границе раздела являются следствием гидратации ионов в водном растворе и способности металлов переходить из металлического состояния в ионное. Явление гидратации связано с тем, что недиссоциированные молекулы воды не являются электрически нейтральными частицами. Строение молекулы воды таково, что катионы водорода и анион кислорода не находятся на одной прямой линии, а расположены под некоторым углом. Благодаря асимметрии центры тяжести положительных и отрицательных зарядов не совпадают. Наличие в молекуле воды двух полюсов - положительного и отрицательного - создает силовое поле. Такие молекулы называются полярными; в электрическом поле они ведут себя как диполи. Поэтому полярные молекулы воды в зависимости от знака заряда иона, определенным образом ориентируются вокруг него. Благодаря гидратации радиус иона как бы увеличивается, вследствие чего подвижность гидратированных ионов значительно уменьшается. Каждый ион обычно окружен несколькими слоями ориентированных молекул воды. Чем большим числом молекул гидратирован ион, тем больше затруднено его передвижение под действием электрического поля. Притяжение молекул воды к иону быстро уменьшается по мере увеличения расстояния между ними.
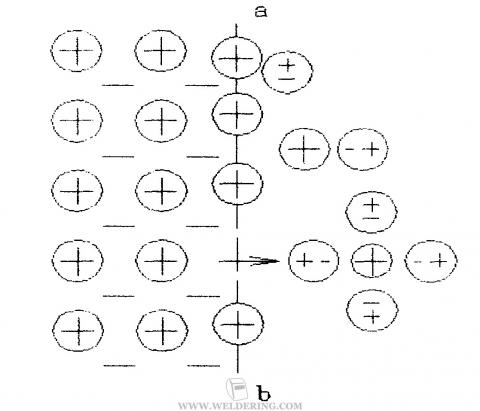
Рассмотрим явление, которое наблюдается на границе металл – электролит. Эти явление вытекают из способности металла переходить из металлического состояния в ионное и гидратации ионов в водном растворе. Когда ионы металлов переходят в раствор (энергия гидратации ионов достаточна для разрыва связей между ион-атомами и электронами), на поверхности металла остается эквивалентное количество электронов, которые в раствор не переходят и сообщают металлу отрицательный заряд. Этот заряд вызывает электростатическое притяжение между положительно заряженными ионами метала, перешедшими в раствор, и поверхностью металла.
Схематическое изображение гидратации и перехода в раствор ионов металла (линия ab показывает поверхность метала).
Указанные явления на границе металл - водный раствор электролита приводят к возникновению двойного электрического слоя, образуемого электрическими зарядами, находящимися на металле, и ионами противоположного заряда, располагающимися у поверхности металла в растворе, что приводит к установлению некоторой разности потенциалов между металлом и раствором электролита (см. рисунок ниже, а).
Схема двойного электрического слоя: а - при переходе иона металла из металла в раствор; б - при переходе катиона из раствора на металл.
Если энергия гидратации не достаточна для разрыва связи между ион-атомами и электронами, т.е. энергия связи в кристаллической решетке превышает энергию гидратации, то на поверхности металла могут разряжаться катионы из раствора. Поверхность металла при этом приобретает положительные заряды, которые с анионами раствора также образуют двойной электрический слой (рисунок б).
Слой на границе металл - раствор можно уподобить плоскому конденсатору, одна обкладка которого заряжена отрицательно, а другая - положительно.
Механизм электрохимической коррозии. Коррозионный процесс возникает вследствие работы множества коротко замкнутых гальванических элементов, образующихся вследствие неоднородности металла или окружающей среды. При этом одновременно протекают два электродных процесса:
1) анодный процесс - переход металлических ионов в раствор с оставлением соответствующего количества избыточных электронов на поверхности металла:
Ме+е + пН2О = Ме+пН2О + е.
2) катодный процесс - ассимиляция избыточных электронов ионами, атомами или молекулами электролита (деполяризаторами), которые при этом восстанавливаются:
е + D → D е .
Наличие электронной проводимости у металла и ионной проводимости у раствора электролита позволяет анодным и катодным процессам протекать раздельно на различных участках поверхности металла. Участок металла, который растворяется, называют анодом, а участок металла, на котором имеет место разряд избыточных электронов - катодом.
Сопряженность анодной и катодной электрохимических реакций при растворении металлов, и протекание их на различных участках корродирующей поверхности, напоминает работу гальванических элементов. Принципиальная схема электрохимического растворения металлов приведена на рисунке выше. Разность потенциалов, возникающая между поверхностью металла и электролитом, называется потенциалом электрода. Причиной возникновения электродных потенциалов является перенос ионов из металла в раствор и обратно.
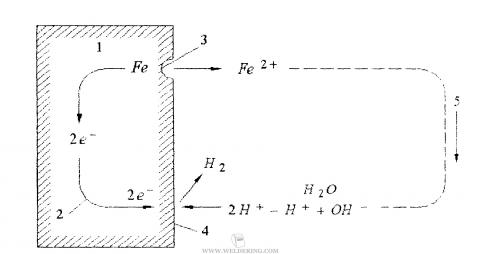
Для примера на рисунке ниже приведена схема электрохимического растворения железа при погружении в раствор. В водном растворе всегда есть ионы Н + и ОН - как продукты частичного распада воды, а также содержится определенное количество кислорода. При погружении в такой раствор железа, его коррозия протекает в условиях образования микрогальванического элемента.
Гальванический микроэлемент поверхности сплава на основе железа в среде раствора 1 - металл; 2 - поток электронов; 3 - анод; 4 - катод; 5 – ток.
Процесс коррозии можно выразить с помощью химических реакций;
- анодная: Fe → Fe2+ + 2e-,
- катодная: 2H+ + 2e- → H2; O2 + 4H+ + 4e- → H2O
Для образования гальванического элемента необходимо, чтобы одновременно протекали катодная и анодная реакции. В случае прекращения одной из них прекращается и развитие коррозии. Одной из причин прекращения этих реакций является переход металла в пассивное состояние из-за образования поверхностной пленки, предотвращающей окисление (анодная поляризация). С повышением окислительных свойств раствора коррозия металла достигает максимальной активности, затем активность резко снижается вплоть до почти полного прекращения коррозии.
Пассивность металлов. Пассивность - это состояние относительно высокой коррозионной устойчивости, вызванное торможением анодной реакции ионизации металла в определенной области потенциалов. Переход металла из активного состояния в пассивное носит название пассивации.
Существует две основные теории пассивности металла. Согласно первой, пленочной теории пассивного состояния, торможение процесса растворения металла наступает вследствие образования на его поверхности фазовой пленки (защитного окисла или слоя) из кислородосодержащих соединений металлов (толщиной от 2 до 10 нм).
Согласно второй, адсорбционной теории, для пассивации достаточно образования мономолекулярного слоя или заполнение лишь части поверхности металла атомами О2 или кислородосодержащих соединений.
Возникновение пассивного состояния зависит от природы металла, его свойств, характера агрессивной среды, концентрации раствора электролита, температуры, движения раствора и целого ряда других факторов. Легко пассивирующимися металлами являются алюминий, хром, никель, титан, вольфрам, молибден, и др.
Легко пассивирующиеся металлы при легировании ими слабо пассивирующихся металлов, как, например, железа, могут передать свою склонность к пассивации этим металлам при условии образования сплавов типа твердых растворов. На этом принципе основано, в частности, получение нержавеющих сталей и чугунов при их легировании кремнием или хромом. Наступление пассивного состояния при этом имеет место при определенном содержании легко пассивирующихся элементов в сплаве, часто сравнительно небольшом.
Виды коррозии. Если коррозия распространяется на всю поверхность металла, то такой вид коррозии называю общей, или сплошной коррозией. Сплошная коррозия, распространяющаяся примерно с одинаковой скоростью по всей поверхности металла, называется равномерной, а распространяющаяся с неодинаковой скоростью на различных участках металла - неравномерной.
Равномерная коррозия наблюдается в тех случаях, когда агрессивные среды не образуют защитных пленок на металле или когда сплав состоит из равномерно распределенных мелкозернистых анодных и катодных участков. Это наименее опасный вид коррозии, при условии, что скорость растворения металла не превышает норм, определяемых шкалой коррозионной стойкости.
Если коррозия вызывает разрушение только некоторых отдельных участков поверхности металла, а остальная часть поверхности не подвергается разрушению, то такой вид коррозии называют местным. Местная коррозия бывает различных типов, из которых наиболее характерны следующие:
1) коррозия пятнами, если разрушение на отдельных участках распространяется сравнительно неглубоко и занимает относительно большие участки поверхности металла;
2) язвенная коррозия, характеризуется довольно глубокими сосредоточенными поражениями металла на сравнительно ограниченных участках поверхности;
3) точечная коррозия, также сосредоточена на отдельных участках поверхности металла, но характер разрушения точечный, причем эти поражения могут перейти в сквозные. Точечная коррозия характерна для пассивирующихся металлов (хром, алюминий, хромоникелевые стали и др.) и возникает в результате повреждения на отдельных участках пассивной пленки. Поврежденные участки в гальванической паре играют роль анодов, другие участки пленки - катодов, что при малой поверхности анодов способствует распространению коррозии вглубь металла.
Случаи точечной коррозии характерны для хромистых и хромоникелевых сталей в морской воде. Эти стали легко пассивируются кислородом воздуха или кислородом, растворенным в морской воде. Защитная же пленка разрушается хлор-ионом морской воды. Активные ионы проникают через микропоры пленки или поврежденные участки пленки и металл начинает разрушаться. Точечная коррозия наблюдается при действии водопроводной воды.
4) подповерхностная коррозия, является местной, но характер ее разрушения отличен от рассмотренных выше. Подповерхностная коррозия - разрушение, начинающееся на поверхности металла, но распространяющееся в дальнейшем преимущественно под поверхностью металла, так что продукты коррозии оказываются сосредоточенными внутри металла; по этим причинам подповерхностная коррозия часто вызывает вспучивание и расслоение металла.
5) Избирательная коррозия известна двух видов. Если разрушается один компонент сплава, то такой вид разрушения носит название компонентно избирательной коррозии; если же в раствор переходит только одна структурная составляющая гетерогенного сплава коррозия называется структурно избирательной.
К избирательной коррозии можно также отнести межкристаллитную коррозию (МКК), которая характеризуется избирательным разрушением по границам кристаллитов (зерен металла). Ей подвержены коррозионностойкие высокохромистые и хромоникелевые стали, медно-алюминиевые, магниево-алюминиевые и другие. Склонность к МКК чаще всего возникает при распаде некоторых твердых растворов в определенных условиях. Так, в хромоникелевых и высокохромистых сталях МКК связана с обеднением твердого раствора по границам зерен хромом из-за выделения в этой зоне карбидов хрома. Причиной обеднения границ зерен хромом является высокая скорость диффузии углерода и низкая хрома, вследствие чего в образовании карбидов участвует почти весь углерод сплава, а хром - только в пограничной зоне, где и идет образование карбидов. Особенно интенсивно выделение карбидов происходит в интервале температур 500...800°С, поэтому МКК наиболее часто проявляется в сварных конструкциях, что связано со спецификой воздействия на металл термического цикла сварки.
Разновидностью межкристаллитной коррозии является ножевая - это разрушение околошовной зоны сварного соединения. Ножевая коррозия проявляется также при многослойной сварке. Коррозия поражает те участки сварных соединений, которые сначала подвергаются нагреву до температур близких к Тпл, а затем отпуску в интервале температур 700...600°С.
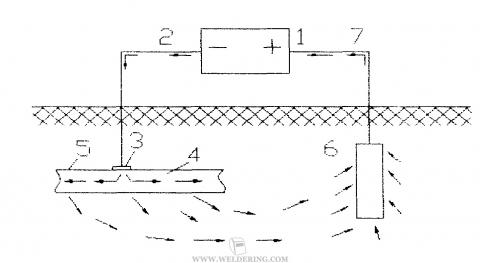
Виды электрохимической защиты. Электрохимическая защита металлов от коррозии основана на уменьшении скорости коррозии металлических конструкций путем их катодной или анодной поляризации. Наибольшее распространение нашла так называемая катодная защита металлов, которая может осуществляться присоединением защищаемой металлической конструкции или к отрицательному полюсу внешнего источника постоянного тока (т.е. в качестве катода), или к металлу, имеющему более отрицательный потенциал. Первый способ зашиты металлов, осуществляемый подачей постоянного тока от внешнего источника, получил название катодной защиты, а второй, осуществляемый путем присоединения защищаемой конструкции к электроду, обладающему потенциалом, более отрицательным чем защищаемая поверхность - проекторной защиты.
На рисунке показана катодная защита внешним током подземного трубопровода. К отрицательному полюсу внешнего источника тока подключается защищаемая конструкция, а к положительному полюсу - дополнительный электрод. От отрицательного полюса источника тока 1 через провод 2 отрицательные заряды поступают в пункте дренажа 3 на защищаемую трубу 4 и текут по ней, попадая через дефектные места изолирующего покрытия 5 в грунт. Из грунта ток переходит на анодное заземление 6, откуда по проводу 7 возвращается к положительному полюсу своего источника. Поверхность металлической трубы при этом поляризуется катодно и защищается от коррозионного разрушения, а анодное заземление, для которого обычно применяются ненужные стальные балки, рельсы или другой металлический лом, активно разрушаются.
По принципу электрохимической защиты используют также анодные и катодные металлические покрытия. Металл анодных покрытий имеет электродный потенциал, более отрицательный чем потенциал защищаемого металла. В случае применения анодных покрытий, необязательно чтобы оно было сплошным. При действии растворов электролитов в возникающем коррозионном элементе основной металл - покрытие основной металл является катодом и поэтому при достаточно большой площади покрытия не разрушается, а защищается электрохимически за счет растворения металла покрытия. Примерами анодных покрытия является покрытие железа цинком и кадмием.
Катодные металлические покрытия, электродный потенциал которых более электроположителен, чем потенциал основного металла, могут служить надежной защитой от коррозии только при условии отсутствии в них пор, трещин и других дефектов, т.е. при условии их сплошности, так как они механически препятствуют проникновению агрессивной среды к основному металлу. Примерами катодных защитных покрытий является покрытие железа медью, никелем, хромом и другими более электроположительными металлами.
Для количественных измерений коррозии металлов применяют самые разнообразные методы - весовой, объемный, электрохимические, электрические, магнитометрические и др.
Испытания на коррозионную стойкость должны учитывать механизм коррозионного разрушения. Испытания на стойкость к МКК проводят погружением в горячую кислоту с последующим взвешиванием через фиксированные интервалы времени образцов до и после испытания. Испытания на стойкость к общей коррозии проводят потенциодинамическими методами со снятием анодных поляризационных кривых без внешней поляризации в агрессивной среде.
Испытания на коррозию регламентируются DIN 50 905: Коррозионные испытания. Рекомендации по проведению и оценке.